โรคฮันติงตัน (Huntington's Disease)
โรคฮันติงตันเป็นโรคทางพันธุกรรมที่ส่งผลต่อการทำงานของสมอง ทำให้เกิดการเคลื่อนไหวผิดปกติ ความผิดปกติทางอารมณ์ และการเสื่อมของความคิดที่ค่อย ๆ รุนแรงขึ้น โรคนี้พบมากในประชากรยุโรปและอเมริกาเหนือ โดยมีความชุกประมาณ 3–7 ต่อประชากร 100,000 คน ขณะที่ในเอเชียพบได้น้อยกว่ามาก ส่วนใหญ่ต่ำกว่า 1 ต่อ 100,000 คน มักเริ่มแสดงอาการในช่วงอายุ 30–50 ปี แต่ก็สามารถเกิดได้ตั้งแต่วัยเด็กจนถึงวัยสูงอายุ โดยพบได้ใกล้เคียงกันทั้งในเพศชายและหญิง
สาเหตุเกิดจากการกลายพันธุ์ของยีน HTT (Huntingtin) บนโครโมโซม 4p16.3 จากการขยายซ้ำผิดปกติของเบส CAG โรคนี้ถ่ายทอดทางพันธุกรรมแบบ autosomal dominant ทำให้บุตรมีโอกาส 50% ที่จะได้รับยีนผิดปกติหากบิดาหรือมารดาเป็นโรค อีกทั้งจำนวนซ้ำของ CAG มักเพิ่มขึ้นเมื่อถ่ายทอดผ่านสายพ่อ ส่งผลให้ผู้ป่วยรุ่นถัดไปแสดงอาการเร็วขึ้นและรุนแรงกว่าเดิม
ช่วงจำนวนซ้ำ CAG ที่สัมพันธ์กับโรค
- ≤ 26: ปกติ
- 27–35: intermediate (ไม่ก่อโรคในผู้ถือยีน แต่มีความเสี่ยงขยายซ้ำในรุ่นลูก)
- 36–39: reduced penetrance (อาจมีหรือไม่มีอาการ)
- ≥ 40: ก่อโรคแน่นอน (full penetrance)
- ในกรณีที่เป็นแบบวัยเด็ก (Juvenile HD) มักพบจำนวนซ้ำสูงมาก เช่น ≥ 60
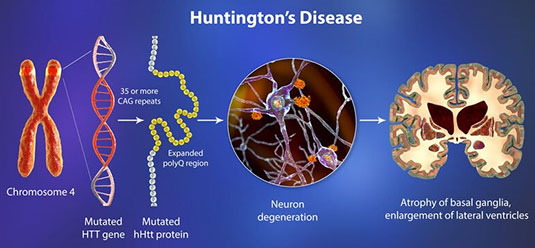
พยาธิสภาพหลักของโรคคือการเสื่อมของ caudate nucleus และ putamen ใน basal ganglia ทำให้การควบคุมการเคลื่อนไหว อารมณ์ และความคิดบกพร่อง
อาการและอาการแสดง
ด้านการเคลื่อนไหว
- Chorea: การกระตุกหรือขยับตัวแบบไม่ตั้งใจ รวดเร็ว และไม่เป็นจังหวะ
- กล้ามเนื้อเกร็ง (dystonia), การทรงตัวไม่ดี ล้มง่าย พูดหรือกลืนลำบาก
- แบบวัยเด็ก (Westphal variant): มักแสดงอาการแข็งเกร็ง เคลื่อนไหวน้อย (akinetic-rigid) และอาจมีอาการชักร่วมด้วย
ด้านจิตใจและพฤติกรรม
- ซึมเศร้า วิตกกังวล หงุดหงิด หรือก้าวร้าว
- มีความคิดหมกมุ่นหรือย้ำคิดย้ำทำ (obsessive-compulsive) บางรายอาจมีอาการจิตเภทหรือหลงผิด
- บกพร่องในการควบคุมอารมณ์และแรงกระตุ้น
ด้านความรู้ความเข้าใจ
- บกพร่องของ executive function เช่น การวางแผน การจัดลำดับ หรือความยืดหยุ่นทางความคิด
- ความจำระยะสั้นและการตัดสินใจเสื่อมถอย จนเข้าสู่ภาวะสมองเสื่อมในระยะท้าย
การวินิจฉัยโรคฮันติงตัน
- ประวัติและตรวจร่างกายระบบประสาท: สังเกตอาการ chorea, ดิสโทเนีย, ความผิดปกติของการทรงตัว และประวัติครอบครัว
- การทดสอบทางพันธุกรรม: ตรวจยืนยันจำนวนซ้ำ CAG ในยีน HTT (ถือเป็นมาตรฐานทองคำ)
- ภาพถ่ายสมอง (MRI/CT): มักพบการฝ่อลีบของ caudate nucleus และการขยายของโพรงสมองส่วน frontal horns
- การประเมินด้านจิตเวชและประสาทจิตวิทยา: ตรวจหาภาวะซึมเศร้า ความคิดฆ่าตัวตาย และความบกพร่องทางการรู้คิด
- การแยกโรค: เช่น ภาวะเคลื่อนไหวผิดปกติจากยา (tardive dyskinesia), โรค Wilson, ไทรอยด์เป็นพิษ, ภาวะภูมิคุ้มกันผิดปกติ, หรือ chorea จากการติดเชื้อและโรคหลอดเลือดสมอง
การรักษา
ปัจจุบันยังไม่มีวิธีรักษาให้หายขาด การรักษามุ่งเน้นที่การบรรเทาอาการ รักษาคุณภาพชีวิต และเตรียมการดูแลระยะยาว
1. การรักษาอาการเคลื่อนไหว
- VMAT2 inhibitors: เช่น tetrabenazine หรือ deutetrabenazine ใช้ลดอาการ chorea
- ยาต้านโรคจิตชนิดไม่ทั่วไป: เช่น risperidone, olanzapine ช่วยควบคุมอาการเคลื่อนไหวและพฤติกรรม
- ยาคลายกังวล/กล้ามเนื้อ (เช่น benzodiazepines) ใช้เป็นครั้งคราวโดยต้องระมัดระวัง
2. การรักษาด้านจิตเวชและความคิด
- ยาต้านซึมเศร้า (SSRIs/SNRIs) สำหรับภาวะซึมเศร้าและอาการย้ำคิดย้ำทำ
- ยาควบคุมอารมณ์ เช่น valproate, carbamazepine สำหรับผู้ที่มีอารมณ์แปรปรวนหรือหุนหันพลันแล่น
- จิตบำบัด ควบคู่กับการสนับสนุนครอบครัวและผู้ดูแล
3. การฟื้นฟูและการดูแลเชิงระบบ
- กายภาพบำบัด/กิจกรรมบำบัด: เพื่อปรับปรุงการทรงตัว การเดิน และการทำกิจวัตร
- การพูดและการกลืน: ฝึกการกลืน ป้องกันการสำลัก พร้อมวางแผนโภชนาการ (อาหารพลังงานสูงเพราะร่างกายใช้พลังงานมาก)
- อุปกรณ์ช่วยเหลือ: เช่น walker และการปรับสิ่งแวดล้อมในบ้านเพื่อลดความเสี่ยงจากการหกล้ม
- การวางแผนการดูแลล่วงหน้า: การตัดสินใจด้านกฎหมายและการแพทย์ในอนาคต
4. งานวิจัยและการรักษาเชิงสาเหตุ (อยู่ระหว่างศึกษา)
- การลดระดับโปรตีน huntingtin ด้วย antisense oligonucleotides หรือ RNA interference
- การแก้ไขยีนด้วยเทคนิคใหม่ (เช่น CRISPR) และการใช้สารที่ช่วยชะลอการเสื่อมของระบบประสาท
พยากรณ์โรค
โรคฮันติงตันมีการดำเนินโรคที่ก้าวหน้าอย่างต่อเนื่อง ส่งผลให้ผู้ป่วยสูญเสียความสามารถในการใช้ชีวิตประจำวัน อายุขัยเฉลี่ยหลังเริ่มแสดงอาการอยู่ที่ประมาณ 15–20 ปี โดยในกลุ่มที่เริ่มเป็นตั้งแต่วัยเด็ก มักดำเนินโรคเร็วกว่าและมีอายุขัยสั้นกว่า
สาเหตุการเสียชีวิตที่พบได้บ่อย ได้แก่ ปอดบวมจากการสำลัก การติดเชื้อ ภาวะแทรกซ้อนจากการหกล้มและบาดเจ็บ รวมถึงปัญหาด้านโภชนาการ
การป้องกันและการให้คำปรึกษาทางพันธุกรรม
ไม่สามารถป้องกันโรคได้ในผู้ที่มียีนกลายพันธุ์แล้ว แต่สามารถลดความเสี่ยงในรุ่นถัดไปได้ด้วยแนวทางดังนี้
- การให้คำปรึกษาทางพันธุกรรม: สำหรับผู้ที่มีประวัติครอบครัวหรือคู่สมรสของผู้ป่วย
- การตรวจยีนเชิงคาดการณ์ (predictive testing): สำหรับผู้ใหญ่ที่มีความเสี่ยงแต่ยังไม่มีอาการ โดยสมัครใจและต้องมีการดูแลด้านจิตใจควบคู่
- การตรวจทารกก่อนคลอด: เช่น การตรวจชิ้นเนื้อรก (CVS) หรือการเจาะน้ำคร่ำ
- การคัดกรองตัวอ่อนก่อนฝังตัว (PGT-M): ใช้ร่วมกับกระบวนการเด็กหลอดแก้วเพื่อคัดเลือกตัวอ่อนที่ไม่มียีนผิดปกติ
คำแนะนำในการดูแลผู้ป่วยและผู้ดูแล
- ติดตามอาการอย่างสม่ำเสมอกับทีมสหสาขาวิชาชีพ เช่น ประสาทวิทยา จิตเวช กายภาพบำบัด และโภชนาการ
- เฝ้าระวังภาวะซึมเศร้าและความคิดทำร้ายตนเองอย่างจริงจัง
- ปรับสิ่งแวดล้อมให้ปลอดภัย ลดความเสี่ยงการหกล้มและอุบัติเหตุ
- วางแผนด้านการเงิน กฎหมาย และการดูแลระยะยาวตั้งแต่ช่วงแรกของโรค
- เข้าร่วมกลุ่มสนับสนุนผู้ป่วยและผู้ดูแล เพื่อลดภาระทางอารมณ์และแลกเปลี่ยนประสบการณ์
สรุป
โรคฮันติงตันเป็นโรคทางพันธุกรรมที่ถ่ายทอดแบบ autosomal dominant เกิดจากการขยายซ้ำของ CAG ในยีน HTT ส่งผลให้สมองส่วน basal ganglia เสื่อม และทำให้เกิดอาการเคลื่อนไหวผิดปกติ (โดยเฉพาะ chorea) ร่วมกับความผิดปกติทางอารมณ์และความคิดที่ค่อย ๆ รุนแรงขึ้น การวินิจฉัยยืนยันได้ด้วยการตรวจยีน
แม้ปัจจุบันยังไม่สามารถรักษาให้หายขาด แต่การรักษาแบบประคับประคอง การใช้ยา และการดูแลร่วมกันของทีมสหสาขาสามารถช่วยบรรเทาอาการและยืดคุณภาพชีวิตได้ การให้คำปรึกษาทางพันธุกรรม การตรวจเชิงคาดการณ์ และการคัดกรองตัวอ่อนถือเป็นทางเลือกสำคัญสำหรับการวางแผนครอบครัวในผู้ที่มีความเสี่ยง ขณะเดียวกันงานวิจัยด้านการลดโปรตีน huntingtin และเทคโนโลยีแก้ไขยีนเป็นความหวังสำหรับการรักษาเชิงสาเหตุในอนาคต